|
|

|
| ||
|
|
||
► Боби I. Аминҳо. Аминокислотаҳо. Пайвастагиҳои ҳетеросиклии нитрогендор
► Амидҳо:сохт, истеҳсол ва хосиятҳои онҳо
► Аминокислотаҳо
► Намунаҳои ҳалли мисол ва масъалаҳо
► Мисол ва масъалаҳо барои ҳалли мустақилона
► Пайвастагиҳои ҳетеросиклии нитрогендор
► Савол ва супоришҳо ва таҷрибаҳои лабораторӣ
► Боби IV. Синтези моддаҳои калонмолекула ва масолеҳи полимерӣ дар асоси онҳо
► Методҳои асосии синтези полимерҳо
► Полимеризатсия
► Моддаҳои пластикӣ
► Каучукҳои синтезӣ
► Нахҳои синтезӣ
► Саволҳо ва таҷрибаҳои лабораторӣ ► Мисол ва масъалаҳо барои ҳалли мустақилона
► Боби V. Ҷамъбасти омӯзиши курси химияи органикӣ
► Намудҳои изомерия
► Изомерияи структурӣ
► Изомерияи занҷири атомҳои карбон
► Изомерияи ҳолати бандҳои дучанда ва сечанда дар молекула
► Изомерияи ҳолати гурӯҳҳои функсионалӣ ё атомҳои алоҳида дар молекула
► Изомерияе, ки ба пайвастагиҳои органикии дар таркиби молекулаашон ҳалқаи бензолӣ дошта хос аст
► Изомерияи фазоӣ ё стереоизомерия
► Табиати электронии банди химиявӣ
► Синтезҳои муҳими саноатӣ дар асоси коркарди нафт ва дигар ашёҳои карбоҳидрогенӣ
► Намунаи ҳалли масъалаҳо ва саволҳо барои ҷавоб
► Масъалаҳо барои ҳалли мустақилона
► Системаи даврии муосири элементҳои химиявӣ
► Мавқеи лантаноидҳо ва актиноидҳо дар системаи даврии элементҳои химиявӣ
► Валентнокӣ ва имкониятҳои валентии атомҳо
► Саволҳо барои ҷавоб ва намунаи ҳалли масъалаҳо
► Масъалаҳо барои ҳалли мустақилона
► Сохти фазоии молекулаи моддаҳои органикӣ ва ғайриорганикӣ
► Навъҳои панҷараҳои кристаллӣ ва хосияти моддаҳо
► Пайвастагиҳои комплексӣ
► Ададҳои координатсионӣ
► Системаҳои дисперсӣ
► Саволҳо барои ҷавоб ва намунаҳои ҳалли масъалаҳо
► Масъалаҳо барои ҳалли мустақилона
► Боби VIII. Реаксияҳои химиявӣ
► Таснифи реаксияҳои химиявӣ
► Суръати реаксияҳои химиявӣ
► Қонуни таъсири масса. Собити мувозинат
► Принсипи Ле-Шателе. Лағжиши мувозинати химиявӣ
► Катализ ва гидролиз
► Саволҳо барои ҷавоб ва намунаҳои ҳалли масъалаҳо
► Масъалаҳо барои ҳалли мустақилона
► Саҳми олимони асрҳои миёнаи тоҷик дар инкишофи химия
► Асосҳои илмӣ ва принсипҳои умумии технологияи химиявӣ
► Химия ва ҳифзи муҳити зист
► Химия дар ҳаёти мо
► Химиконии кишоварзӣ
► Саволҳо барои ҷавоб
► Замима
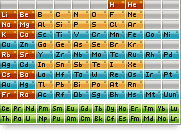

ТАВСИФИ ҒАЙРИМЕТАЛЛҲО
Элементҳои химиявӣ ба ду гурӯҳи калон ҷудо мешаванд: металлҳо ва
ғайриметаллҳо. Ба металлҳо элементҳое, ки моддаҳои соддаи онҳо дорои
электронҳои озод мебошанд, мансубанд. Элементҳои химиявии боқимондаро
гурӯҳи ғайриметаллҳо ташкил мекунанд.
Ғайриметаллҳо ба се гурӯҳ ҷудо
мешаванд: ғайриметаллҳои хос, газҳои асил (инертӣ) ва ҳидроген.
Ҳидроген. Ба гурӯҳи алоҳида ҷудо намудани ҳидроген ба
хусусиятҳои сохти электрониаш алоқаманд аст. Ҳидроген дар қабати беруна
ва ягонаи электронии худ як электрон дорад. Конфигуратсияи электронии
ҳидроген 1s1 мебошад. Ҳидроген мисли металлҳои ишқорӣ як
электронашро дода, чун ҳалогенҳо як электронро метавонад ба худ пайваст
намояд ва хосияти амфотерӣ зоҳир намояд. Бинобар ин хосиятҳои химиявии
ҳидроген ҳам хосияти металлҳои ишқорӣ ва ҳам хосияти ҳалогенҳоро дар бар
мегиранд.
Спектри ҳидроген ба спектри металлҳои ишқорӣ монанд аст. Чун
металлҳои ишқорӣ ҳидроген барқароркунандаи қавӣ мебошад:
Дар айни замон ҳидроген чун ҳалогенҳо хосияти оксидкунандагӣ зоҳир менамояд:
Дар ҳамаи пайвастагиҳои ҳидроген бо металлҳо, ки ҳидридҳо ном доранд,
аниони ҳидроген (Н) яквалента аст. Ҳидридҳо бо сохт ва табиати
бандҳояшон ба ҳалогенидҳо монанд мебошанд.
Газҳои инертӣ. Ба газҳои инертӣ (асил)
элементҳои химиявии зерин мансубанд: ҳелий, неон, аргон, криптон, ксенон
ва радон. Ҳамаи элементҳои гурӯҳи 18-уми ҷадвали даврӣ ба газҳои инертӣ
мансубанд. Барои газҳои инертӣ пур будани қабати берунаи электрониашон
хос аст. Бо ҳамин сабаб онҳо аз назари химиявӣ бағоят камфаъол мебошанд.
Онҳо бо элементҳои дигар бо душворӣ пайваст мешаванд. Атомҳои газҳои
инертӣ бо ҳам пайваст намешаванд ва аз ин сабаб молекуларо ташкил
намекунанд, яъне газҳои инертӣ аз атомҳо иборатанд. Солҳои тӯлонӣ ҳисоб
мекарданд, ки атомҳои газҳои инертӣ бо атомҳои элементҳои дигар, умуман,
қобилияти ташкил намудани бандҳои химиявиро надоранд. Вале дар
даҳсолаҳои охир муайян гардид, ки криптон, ксенон ва радон бо элементҳои
дигар, пеш аз ҳама бо фтор, пайвастагиҳои химиявӣ ҳосил карда метавонанд.
Дар натиҷаи таъсири бевоситаи газҳои инертӣ бо фтор фторидҳои KrF2,
XeF2, KrF4, XeF4 ва RnF4
ҳосил карда шуданд. Вале пайвастагиҳои химиявии ҳелий, неон ва аргон
ҳанӯз маълум нестанд.
Сабаби нисбати ҳелий, неон ва аргон фаъолтар будани
криптон, ксенон ва радон аз назари сохти электронии элементҳо равшан аст.
Потенсиалҳои ионшавии криптон, ксенон ва радон нисбат ба потенсиалҳои
ионшавии ҳелий, неон ва аргон хурдтаранд ва ин боиси фаъолияти
баландтари химиявии онҳо мегардад.
Ғайриметаллҳои хос. Ба ин гурӯҳ 15 элементи
химиявӣ дохил мешаванд. Ин элементҳо ба гурӯҳҳои 13-17-и системаи даврии
элементҳо мансубанд. Агар дар системаи даврии Д.И. Менделеев элементҳои
бор, фтор ва астатро бо ҳамдигар бо хатҳои рост пайваст намоем, он гоҳ
секунҷае ҳосил менамоем, ки ҳамаи ғайриметаллҳои хосро дар бар мегирад.
Хосиятҳои муштараки элементҳои ин гурӯҳ аз монандии сохти электрониашон
бармеоянд.
Ҳамаи ғайриметаллҳои хос ба р-элементҳо мансубанд, яъне
электронҳои валентии ин элементҳо дар р-қишри қабати берунаи электронӣ
ҷойгир шудаанд. Электроманфигии ин элементҳо нисбатан калон буда,
қиммати ададии он аз 2 то 4 тағйир меёбад.
Бояд қайд намоем, ки минбаъд ҳангоми истифодаи истилоҳи
ғайриметаллҳо танҳо ғайриметаллҳои хос дар назар дошта мешаванд.
Азбаски ғайриметаллҳо электронҳоро ҷазб мекунанд, онҳо асосан
хосияти оксидкунандагӣ зоҳир менамоянд. Электроманфигии
элемент чӣ қадаре зиёд бошад, вай ҳамон қадар хосияти баландтари
оксидкунандагӣ зоҳир менамояд. Қобилияти оксидкунандагии ғайриметаллҳо
дар қатори зерин аз тарафи чап ба рост зиёд мешавад:
Чи тавре аз қатор мебинем фтор оксидкунандаи қавитарин аст. Вай бо ҳидроген ва металлҳо бо суръати калон ба реаксия дохил мешавад:
Фтор ҳатто бо газҳои инертӣ таъсири мутақобил мекунад:
Фтор
ҳамчун ғайриметалли хостарин қобилияти барқароркунандагӣ, яъне дар
реаксияҳои химиявӣ қобилияти додани электронро, надорад. Оксиген бошад,
дар пайвастагиҳояш бо фтор қобилияти барқароркунандагӣ зоҳир менамояд:
OF2, O2F2. Ҳамаи ғайриметаллҳои боқимонда низ қобилияти барқароркунандагӣ зоҳир менамоянд, вале
қобилияти барқароркунандагии онҳо нисбат ба металлҳо хеле пасттар аст.
Қобилияти барқароркунандагии ғайриметаллҳо дар қатори зерин
аз тарафи чап ба рост зиёд мешавад:
Хлор дар пайвастагиҳояш бо оксиген дараҷаи мусбати оксидкунандагӣ зоҳир менамояд:
Нитроген низ дар пайвастагиҳояш бо оксиген қобилияти барқароркунандагӣ зоҳир менамояд:
Пайвастагиҳои хлорро бо оксиген бо роҳи бевосита таъсир намудан ҳосил кардан мумкин нест. Нитроген бо оксиген дар ҳароратҳои баланд пайваст мешавад, ки дар ин маврид танҳо NO ҳосил мешавад. Оксидҳои дигари нитрогенро бо роҳҳои дигар ҳосил кардан мумкин аст. Сулфур бошад, бо оксиген дар ҳарорати пасттар ба реаксия дохил шуда метавонад:
Сулфур хосияти оксидкунандагӣ низ зоҳир менамояд:
Ҳамин тавр,
қобилияти оксидкунандагӣ хусусияти хоси ғайриметаллҳо мебошад. Қобилияти
барқароркунандагии ғайриметаллҳо танҳо нисбат ба он элементҳое зоҳир
мешавад, ки электроманфигиашон калонтар аст.
Сохти ғайриметаллҳо. Ғайриметаллҳо
сохти гуногун доранд.
Қисми бештари ғайриметаллҳо сохти молекулавӣ
доранд. Масалан, молекулаи ҳалогенҳо, оксиген ва нитроген аз ду атом
иборатанд. Молекулаи сулфур 8 атом дорад. Моддаҳои соддаи фтор, нитроген,
хлор ва оксиген газ мебошанд. Моддаи соддаи бром моеъ, вале моддаҳои
соддаи сулфур, йод ва фосфор сахт мебошанд.
Ғайриметаллҳои боқимонда С, B ва Si сохти
ғайримолекулавӣ доранд. Моддаҳои соддаи онҳо сахт мебошанд.
Бояд қайд намоем, ки дар ғайриметаллҳо ҳодисаи
аллотропия хеле зиёд ба чашм мерасад. Аллотропия ин мавҷудияти элементи
химиявӣ дар шакли якчанд моддаи содда мебошад, ки аз ҳамдигар бо
хосиятҳояшон фарқ мекунанд.
Оксиген ду намуди моддаи содда дорад: оксиген (O2)
ва озон (O3). Фосфор бошад се шакли аллотропӣ дорад: сафед,
сурх ва сиёҳ. Молекулаҳои фосфори сафед аз чор атом иборатанд.
Молекулаҳои фосфори сурх сохти полимерӣ доранд. Сулфур якчанд намуди
моддаи содда дорад, ки аз ҳамдигар бо панҷараҳои кристаллиашон фарқ
мекунанд.
Шаклҳои аллотропии кристаллии карбон ба шумо шиносанд.
Онҳо графит ва алмос мебошанд. Карбон шаклҳои аллотропии ғайрикристаллӣ
низ дорад. Кокс яке аз моддаҳои соддаи аморфии карбон мебошад. Бо роҳи
сунъӣ аллотропҳои дигари карбон аз қабили карбин ва поликумулен, ки
сохти полимерҳои хаттиро доранд, ҳосил карда шудаанд.
Хусусиятҳои хоси химиявии ғайриметаллҳо.
Бор. Конфигуратсияи электронии бор чунин аст:
Сарфи
назар аз он, ки бор дар гурӯҳи 13-уми системаи даврӣ ҷойгир аст, вай бо
хосиятҳои худ на ба элементҳои ин гурӯҳ, балки бо элементи гурӯҳи 14-ум
силитсий монандӣ дорад. Бор чун силитсий кислотаҳои заиф ҳосил мекунад.
Пайвастагиҳои ҳидрогении бор ва силитсий моддаҳои бухоршаванда мебошанд,
дар ҳаво худ ба худ аланга мегиранд. Бор чун силитсий бо металлҳо
пайвастагиҳое ҳосил мекунад, ки бештари онҳо сахтгудоз ва дорои сахтии
калон мебошанд.
Об ба бор таъсир намекунад. Кислотаҳои консентронидаи сулфат
ва нитрат борро то кислотаи борат оксид мекунанд:
Дар ҳарорати муқаррарӣ бор танҳо бо фтор пайваст мешавад. Дар ҳарорати 700°С бор бо оксиген низ пайваст мешавад:
Дар ҳарорати баланд бор бо аксари металлҳо пайваст шуда, боридҳоро ҳосил мекунад:
Ҳангоми гарм намудани омехтаи бор бо карбон карбиди бор ҳосил мешавад:
Бор ҳангоми
гармкунӣ бо ҳалогенҳо низ пайвастагиҳо ҳосил мекунад, ки формулаи
умумиашон BX3 мебошад.
Карбон. Конфигуратсияи электрониаш чунин аст:
Карбон ҳам
қобилияти оксидкунандагӣ ва ҳам барқароркунандагӣ зоҳир менамояд.
Қобилияти оксидкунандагии карбон беш аз ҳама дар ҳосил
намудани карбидҳо аён мешавад:
Қобилияти барқароркунандагии карбон ҳангоми таъсири мутақобилаш бо оксиген ва барқарор намудани металлҳо аз оксидҳояшон зоҳир мешавад:
Силитсий. Конфигуратсияи қабати берунаи электронии силитсий чунин аст:
Силитсий аз назари химиявӣ хеле камфаъол аст. Вай чун дигар
ғайриметаллҳо ҳам қобилияти оксидкунандагӣ ва ҳам барқароркунандагӣ
зоҳир менамояд.
Қобилияти оксидкунандагии силитсий ҳангоми ҳосил намудани
силитсидҳо аён мешавад. Ин реаксияҳо дар ҳарорати баланд мегузаранд:
Қобилияти барқароркунандагии силитсий ҳангоми таъсири мутақобилаш бо ғайриметаллҳои электроманфигиашон баландтар зоҳир мешавад. Дар ҳарорати муқаррарӣ силитсий танҳо бо фтор пайваст мешавад:
Ҳангоми гарм намудан силитсий бо оксиген, ҳалогенҳо ва сулфур ба осонӣ ба реаксия дохил мешавад:
Кислотаҳо ба ҷуз омехтаи кислотаҳои фторид ва нитрат ба силитсий таъсир намекунанд. Вале бо ишқорҳо силитсий бо шиддат ба реаксия дохил шуда, намакҳои кислотаи силикатро ҳосил мекунад:
Нитроген. Конфигуратсияи электронии нитроген чунин аст:
Дар ҳолати
молекулавӣ моддаи камфаъол аст. Дар шароитҳои муайян ҳам қобиляти
оксидкунандагӣ ва ҳам барқароркунандагӣ зоҳир менамояд.
Қобилияти оксидкунандагии нитроген ҳангоми ҳосил намудани нитридҳо
баръало намоён мешавад. Дар ҳарорати мӯътадил танҳо бо литий пайвастагӣ
ҳосил мекунад. Ҳангоми гарм намудан бо бештари металлҳо, аз ҷумла бо
магний, калсий ва титан ба реаксия дохил мешавад:
Нитроген бо ҳидроген дар ҳарорат ва фишори баланд (400500°С, 1530 МПа) дар иштироки катализатор ба реаксия дохил мешавад:
Қобилияти барқароркунандагии нитроген ҳангоми таъсири мутақобили он бо оксиген зоҳир мешавад. Ин реаксия дар ҳарорати 2000°С мегузарад:
Фосфор. Конфигуратсияи қабати берунаи электронии фосфор чунин аст:
Фосфор
дар ҳолати озод бағоят фаъол аст ва бо бештари моддаҳои содда бевосита
ба реаксия дохил мешавад. Ин реаксияҳо экзотермӣ мебошанд, яъне ҳангоми
гузаштани онҳо энергия хориҷ мешавад.
Қобилияти барқароркунандагии фосфор ҳангоми таъсири
мутақобили он бо оксиген, ҳалогенҳо ва сулфур зоҳир мешавад:
Қобилияти оксидкунандагии фосфор дар реаксияҳояш бо металлҳо ва ҳидроген зоҳир мешавад. Фосфор бо металлҳо пайваст шуда, фосфидҳо ва бо ҳидроген фосфинро ҳосил мекунад:
Арсен. Конфигуратсияи қабати берунаи электронии арсен 4s24p3 мебошад. Дар об ҳалнашаванда аст. Дар ҳарорати мӯътадил оксидшавиаш бениҳоят суст аст. Ҳангоми сахт гарм намудан арсен месӯзад ва оксиди сафеди As2O3 ҳосил мекунад, ки бӯи хоси сирро дорад. Дар ҳарорати баланд арсен бо бисёр элементҳо ба реаксия дохил мешавад. Оксидкунандаҳои қавӣ арсенро ба кислотаи арсенат табдил медиҳанд:
Арсен дар пайвастагиҳояш дараҷаи оксидшавии +5, +3 ва -3-ро зо ҳир мекунад.
Оксиген. Конфигуратсияи электронии оксиген чунин аст:
Оксиген бо ҳамаи элементҳо, ба ғайр аз ҳелий, неон ва аргон, пайвастагиҳо ҳосил мекунад, ки дар онҳо қобилияти окидкунандагиаш зоҳир мешавад. Оксиген бо бисёр элементҳо (ба ғайр аз тилло ва платина) бевосита ба реаксия дохил мешавад. Хусусиятҳои хоси бештари реаксияҳои пайвастшавӣ бо оксиген ин хориҷ намудани гармӣ ва рӯшной мебошад. Ин гуна реаксияҳоро сӯзиш меноманд:
Қобилияти барқароркунандагии оксиген танҳо ҳангоми таъсири мутақобилаш бо фтор зоҳир мешавад:
Озон, ки шакли дигари аллотропии оксиген аст, оксидкунандаи қавӣ мебошад. Ба ғайр аз тилло ва платина, вай тамоми металлҳо ва бештари ғайриметаллҳоро оксид мекунад. Озон оксидҳои пастро ба оксидҳои олӣ табдил медиҳад. Дар ин гуна реаксияҳо молекулаи озон як атомашро гум карда, ба молекулаи оксиген табдил меёбад:
Сулфур. Конфигуратсияи қабати берунаи электронии сулфур чунин аст:
Сулфур, чун дигар ғайриметаллҳо, дар вақти таъсири мутақобилаш бо элементҳои электроманфигиашон калонтар қобилияти барқароркунандагӣ зоҳир менамояд:
Ҳангоми таъсири мутақобил бо элементҳои боқимонда сулфур қобилияти оксидкунандагӣ зоҳир менамояд:
Сулфур бо бисёр металлҳо, аз қабили мис, оҳан ва руҳ бевосита пайваст мешавад. Дар ин реаксияҳо миқдори зиёди гармӣ хориҷ мегардад, яъне ин реаксияҳо экзотермӣ мебошанд:
Ҳалогенҳо. Ҳалогенҳо, ки ба онҳо фтор, хлор, бром, йод ва астат
мансубанд, дар қабати берунаи электрониашон ҳафт электрон доранд: ду
электрон дар s-қишр ва панҷ электрон дар р-қишр
(ns2nр5).
Атомҳои ҳалогенҳо электрони ғайрро ба осонӣ ба худ ҷазб намуда, ба
ионҳои зарядашон манфӣ табдил меёбанд.
Азбаски сохти электронии ҳалогенҳо ба ҳам монанд аст, бинобар
ин хосияти химиявии онҳо низ монанданд. Вале, қатъи назар аз ин, ҳалоген
ҳо аз якдигар фарқ ҳам доранд.
Фтор дар ҳамаи пайвастагиҳояш дараҷаи оксидшавии
-1 зоҳир менамояд. Дараҷаи оксидшавии
ҳалогенҳои дигар аз -1 то +7 тағйир меёбад. Ин
хосияти ҳалогенҳоро дар асоси назарияи сохти электронии элементҳо шарҳ
додан мумкин аст. Ҳангоми ангезиши пай дар пайи атом ҳои Cl, Br, I ва At
электронҳои ҷуфти р-қишр
метавонанд ба s-қишр гузаранд. Дар натиҷа
миқдори электронҳои тоқ дар қабати берунаи электронии ин элементҳо зиёд
шуда, барои 3, 5 ё 7 банди ковалентӣ ташкил намудани ин элементҳо
мусоидат мекунад.
Ҳалогенҳо дар ҳолати озод бағоят
фаъол мебошанд ва қариб бо ҳамаи моддаҳои содда ба реаксия дохил
мешаванд.
Қобилияти оксидкунандагии ҳалогенҳо ҳангоми бо металлҳо ба реаксия дохил
шудани онҳо зоҳир мешавад:
Қобилияти оксидкунандагии ҳалогенҳо ҳангоми таъсири онҳо ба моддаҳои мураккаб низ зоҳир мегардад:
Қобилияти оксидкунандагии ҳалогенҳо дар қатори зерин аз тарафи чап ба рост кам мешавад:
Фтор ҳалогени фаъолтарин аст. Вай бо бисер ғайриметаллҳо, ҳатто дар ҳарорати паст, ба реаксия дохил мешавад. Ин реаксияҳо бо таркиш ва ҳосилшавии шарора мегузаранд:
Ҳангоми гармкунӣ фтор бо хлор, криптон ва ксенон пайваст мешавад.
Хлори озод низ хеле фаъолияти баланди химиявӣ зоҳир менамояд, вале
нисбат ба фтор камфаъолтар аст. Вай бо истиснои оксиген, нитроген ва
газҳои инертӣ бо ҳамаи моддаҳои содда, бевосита таъсири мутақобил
мекунад.
Фаъолиятнокии химиявии бром
ва йод нисбат ба хлор камтар аст. Онҳо бо бисёр металлҳо ва
ғайриметаллҳо дар шароити мӯътадил ба реаксия дохил мешаванд. Дар ин
ҳолат фаъолияти химиявии бром аз хлор камтар, вале аз йод бештар мебошад.
Ҳалогенҳои фаъол анионҳои
ҳалогенҳои камфаъолро оксид мекунанд:
Татбиқи ғайриметаллҳо. Ғайриметаллҳо дар истеҳсолот
татбиқи васеъ доранд.
Бор. Дар
саноат, истеҳсоли хӯлаҳо ба оҳан ва металлҳои ранга бор илова мекунанд,
то ин ки хосиятҳои механикӣ ва тобоварии онҳоро ба зангзанӣ беҳтар
намоянд. Боридҳои баъзе металлҳо беандоза сахтанд ва аз назари химиявӣ
устуворанд. Аз ин сабаб, онҳоро дар сохтани қисмҳои ҳаракатдиҳандаи
мушакҳо ва белчаҳои турбинаҳои газӣ истифода мебаранд. Карбиди бор барои
коркарди хӯлаҳои сахт ба кор меравад. Кислотаи борат H3BO3
барои тайёр намудани рангҳо, навъҳои махсуси шишаҳо ва дар истеҳсоли коғаз
ва пӯст истифода мешавад.
Вай маводи хуби
дезинфексионӣ мебошад. Бура (тетраборати натрий Na2B4O7)
ҳангоми кафшер ва буридани металлҳо, васл кардани зарфҳои чинӣ ва чуянӣ
ба кор меравад. Изотопи бор 10B дар реакторҳои ядроӣ
ба сифати фурӯбарандаи нейтронҳо хизмат мекунад.
Карбон. Алмос
дар коркарди маводҳои бениҳоят сахт, барои буридани ҷинсҳои кӯҳӣ, дар
тайёр намудани ҷавоҳирот истифода мешавад. Аз графит қалам истеҳсол
мекунанд. Аз омехтаи графит ва гил оташдонҳои ба ҳароратҳои баланд
тобовар месозанд. Дар реакторҳои ядроӣ графит
чун фурӯбарандаи нейтронҳо истифода мешавад. Ангиштсангро чун маводи сӯзишворӣ
истифода мебаранд. Кокс дар саноати коркарди металлҳо аҳамияти калон
дорад.
Силитсий. Силитсий
дар саноати коркарди металлҳо ва техникаи нимноқилҳо истифода мешавад.
Онро инчунин барои ҳосил намудани карборунд (карбиди силитсий) ва
қаламҳои силикатӣ, оташдонҳои электрикӣ истифода мебаранд.
Нитроген.
Нитроген дар истеҳсоли саноатии аммиак ашёи хом аст. Онро барои пур
кардани лампаҳо ва муҳайё намудани муҳити нейтралӣ барои гузаронидани
баъзе реаксияҳои химиявӣ истифода менамоянд. Нитрогени моеъ, дар саноат
ва лабораторияҳои илмӣ ҳамчун хунуккунанда истифодаи васеъ дорад.
Фосфор. Фосфор дар
истеҳсоли гӯгирд аҳамияти асосӣ дорад. Вай дар саноати коркарди металлҳо
истифода мешавад. Фосфор дар истеҳсоли нимноқилҳо, ки аҳамияти калони
саноатӣ доранд, яке аз ашёҳои асосӣ ба шумор меравад. Фосфорро инчунин
дар истеҳсоли пеститсидҳо ва инсектитсидҳои фосфорорганикӣ истифода
мебаранд.
Оксиген. Дар
саноати коркарди металлҳо барои ҳосил намудани ҳарорати баланд истифода
мешавад. Оксигенро дар истеҳсоли кислотаҳои нитрат ва сулфат ба кор
мебаранд. Дар тиб низ оксиген васеъ истифода бурда мешавад.
Сулфур. Сулфур дар
истеҳсоли гӯгирд маводи асосӣ мебошад. Вай дар истеҳсоли резин барои ба
резин табдил додани каучу истифода ме шавад.
Ҳалогенҳо. Ҳалогенҳо
дар саноати химиявӣ ба таври васеъ истифода мешаванд. Аз фтор
карбоҳидрогенҳои фтордор истеҳсол мекунанд, ки онҳо ба сифати равғанҳои
молидании ба ҳарорати баланд тобовар хизмат менамоянд. Аз
карбоҳидрогенҳои фтордор, инчунин моддаҳои пластикие истеҳсол мекунанд,
ки аз назари химиявӣ ва физикӣ устувор мебошанд. Хлор дар истеҳсоли
кислотаи хлорид, оҳаки хлордор истифода мешавад. Хлорро барои сафедкунии
матоъ ва селлюлоза, барои безарар намудани оби нӯшокӣ
ва манбаъҳои оби нӯшокӣ ба кор мебаранд. Аз
хлор ҳалкунандаҳои хлорорганикӣ (дихлорэтан, хлороформ ва чорхлориди
карбон), полимерҳои гуногун ва ғайра истеҳсол мекунанд. Бром дар
истеҳсоли маводи доруворӣ истифода мешавад. Бромиди нуқра барои
истеҳсоли маводи расмгирӣ ба кор меояд. Йод дар тиб чун маводи
антисептикӣ ва боздорандаи хунравӣ истифода мешавад.